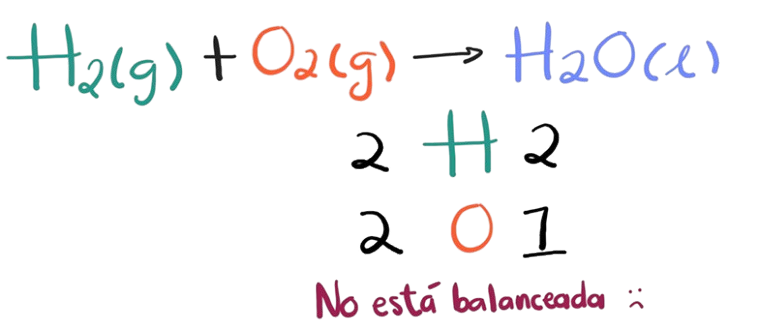¿Cómo realizar el balanceo de Ecuaciones Químicas? Por el Método de Tanteo
Para balancear ecuaciones existen dos técnicas, aquí nos enfocaremos en la técnica de tanteo y lo haremos paso a paso para ayudarte a equilibrar ecuaciones químicas de manera efectiva.
Recuerda que balancear es importante para temas más avanzados en Química.
Si alguna vez te has sentido perdido al intentar balancear una ecuación, ¡este es el lugar para ti!
¿Qué es una Ecuación Química?
Antes de comenzar, es fundamental entender qué es una ecuación química. Una ecuación química representa una reacción química mediante símbolos y fórmulas químicas. Por ejemplo:
En esta ecuación, el H (Hidrógeno) y el O (Oxígeno) reaccionan para formar H 2 O (agua).
Sin embargo, para que la ecuación sea correcta, debe estar balanceada, es decir, el número de átomos de cada elemento debe ser el mismo en ambos lados de la ecuación.
Si verificamos esta reacción notaremos que no está balanceada, puedes notarlo a través de una tabla que puedes escribir debajo de la reacción, cómo se muestra a continuación.
¿Qué es el Método de Tanteo?
El método de tanteo es una técnica práctica para balancear ecuaciones químicas.
Consiste en ajustar los coeficientes (números que están enfrente de cada fórmula química) de los reactivos (especies químicas a la izquierda) y productos (especies químicas a la derecha) para que el número de átomos de cada elemento sea igual en ambos lados de la ecuación.
¡Vamos a hacerlo paso a paso!
Paso 1.
Escribe la ecuación no balanceada o la que quieres balancear
Comencemos con el siguiente ejemplo:
Paso 2
Coloca los elementos involucrados en la reacción preferentemente debajo de la flecha de reacción
Paso 3: Cuenta los átomos de cada elemento que están de lado de los reactivos (a la izquierda, o bien, antes de la flecha de reacción).
Paso 4: Ahora cuenta los átomos de cada elemento que están de lado de los productos (a la derecha, o bien, después de la flecha de reacción).
Paso 5: Ajusta los coeficientes de cada elemento
Consejo: Es útil comenzar con el elemento que aparece en menor cantidad en la ecuación. Recuerda que si cambias el coeficiente esto es una multiplicación y también afecta a los subíndices que tengan los elementos o compuestos.
Por ejemplo
Al colocar el número 2 como coeficiente en el compuesto Fe 2 O 3
(óxido de hierro III), cambia el número de átomos de Fe (Hierro) pero también de O (Oxígeno) como si fuera una multiplicación.
¡Evita errores! ….
Recuerda que solo puedes colocar coeficientes enfrente de un compuesto no en medio.
1. Ajustando a Fe (Hierro) la reacción queda:
2. Ajustando a O (Oxígeno) la reacción queda:
¡Perfecto! La ecuación está balanceada.
Consejos Adicionales:
Empieza con elementos que aparecen en una sola sustancia en ambos lados de la ecuación.
Guarda el hidrógeno como penúltimo y el oxígeno para el final, ya que suelen aparecer en más de una sustancia.
Practica con diferentes ecuaciones para mejorar tu habilidad.
Ahora es tu turno… intenta balancear la siguiente ecuación:
Si quieres ver la respuesta a la ecuación anterior, consulta el siguiente video dónde verás también más a detalle el tema.
¿Aún tienes dudas? Agenda tu clase de química con nosotros
Autor: Karen Adali Martínez-Lic. En Química UNAM| Profesora particular en E-clases